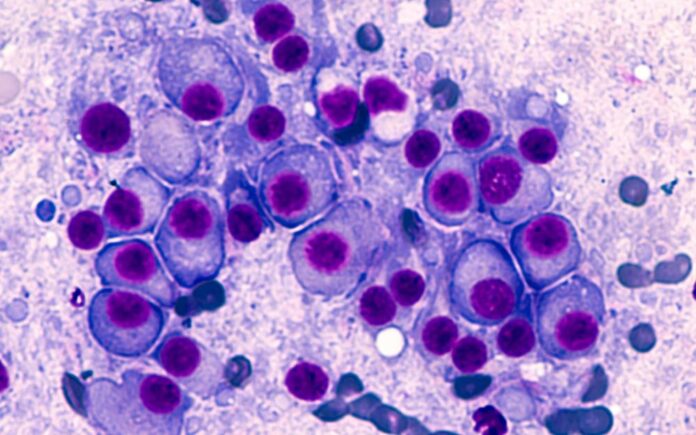
Έγκριση στο μονοκλωνικό αντίσωμα isatuximab το οποίο στοχεύει τον υποδοχέα CD38 στα κύτταρα του πολλαπλού μυελώματος, σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη έδωσε η Ευρωπαϊκή Επιτροπή βασιζόμενη σε δεδομένα από την πρώτη τυχαιοποιημένη μελέτη Φάσης 3 (ICARIA-MM) που αξιολόγησε τη δράση του φαρμάκου. Σύμφωνα με τα ευρήματα η χρήση isatuximab σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη μείωσε στατιστικώς σημαντικά τον κίνδυνο εξέλιξης της νόσου ή θανάτου κατά 40% σε σύγκριση με τον συνδυασμό πομαλιδομίδης και δεξαμεθαζόνης
Σύμφωνα με τους ειδικούς, το πολλαπλό μυέλωμα αποτελεί τη δεύτερη σε συχνότητα εμφάνισης αιματολογική κακοήθεια, με περισσότερα από 138.000 νεοδιαγνωσθέντα περιστατικά παγκοσμίως κάθε χρόνο. Στην Ευρώπη, περίπου 40.000 ασθενείς διαγιγνώσκονται με πολλαπλό μυέλωμα κάθε χρόνο. Το πολλαπλό μυέλωμα παραμένει μια ανίατη κακοήθεια για την πλειονότητα των ασθενών με αποτέλεσμα να σχετίζεται με σημαντικό φορτίο νοσηρότητας.
Το isatuximab είναι ένα μονοκλωνικό αντίσωμα (mAb), το οποίο συνδέεται σε έναν ειδικό επίτοπο του υποδοχέα CD38 στα κύτταρα του πολλαπλού μυελώματος. Η Ευρωπαϊκή Επιτροπή το ενέκρινε σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη για τη θεραπεία ενηλίκων ασθενών με υποτροπιάζον και ανθεκτικό πολλαπλό μυέλωμα, οι οποίοι έχουν λάβει τουλάχιστον δύο προηγούμενες θεραπείες, συμπεριλαμβανομένων της λεναλιδομίδης και ενός αναστολέα πρωτεασώματος, και εμφάνισαν εξέλιξη της νόσου με την τελευταία θεραπεία.
Το isatuximab χορηγείται μέσω ενδοφλέβιας έγχυσης στη δόση των 10 mg/kg, σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη, εβδομαδιαίως για τέσσερις εβδομάδες και στη συνέχεια κάθε δεύτερη εβδομάδα, έως ότου εμφανιστεί εξέλιξη της νόσου ή μη αποδεκτή τοξικότητα. Με δεδομένο ότι δεν θα απαιτηθεί τροποποίηση του ρυθμού έγχυσης λόγω σχετιζόμενων με την έγχυση αντιδράσεων, η πρώτη έγχυση διαρκεί τρεις έως τέσσερις ώρες, η δεύτερη έγχυση διαρκεί λιγότερο από δύο ώρες και ο χρόνος για τις υπόλοιπες εγχύσεις είναι δυνατό να μειωθεί στα 75 λεπτά, από την τρίτη έγχυση και εξής. Ένας κύκλος θεραπείας αντιστοιχεί σε 28 ημέρες. Η άδεια κυκλοφορίας της Ευρωπαϊκής Επιτροπής για το isatuximab ισχύει στα 27 κράτη μέλη της Ευρωπαϊκής Ένωσης, καθώς και στο Ηνωμένο Βασίλειο, την Ισλανδία, το Λιχτενστάιν και τη Νορβηγία.
Εκτός από την ΕΕ, το isatuximab έχει επίσης εγκριθεί στις ΗΠΑ, στην Ελβετία, στον Καναδά και στην Αυστραλία σε συνδυασμό με πομαλιδομίδη και δεξαμεθαζόνη για τη θεραπεία ορισμένων ενηλίκων με υποτροπιάζον ανθεκτικό πολλαπλό μυέλωμα.
Να σημειωθεί ότι η αξιολόγηση του isatuximab συνεχίζεται σε πολλές κλινικές μελέτες Φάσης 3 σε συνδυασμό με τρέχουσες καθιερωμένες θεραπείες για το πολλαπλό μυέλωμα. Μελετάται επίσης για τη θεραπεία άλλων αιματολογικών κακοηθειών και συμπαγών όγκων. Η ασφάλεια και η αποτελεσματικότητα του isatuximab σ’ αυτές τις παθήσεις δεν έχουν αξιολογηθεί πλήρως από καμία ρυθμιστική αρχή παγκοσμίως.
Ανθή Αγγελοπούλου