Της Ανθής Αγγελοπούλου
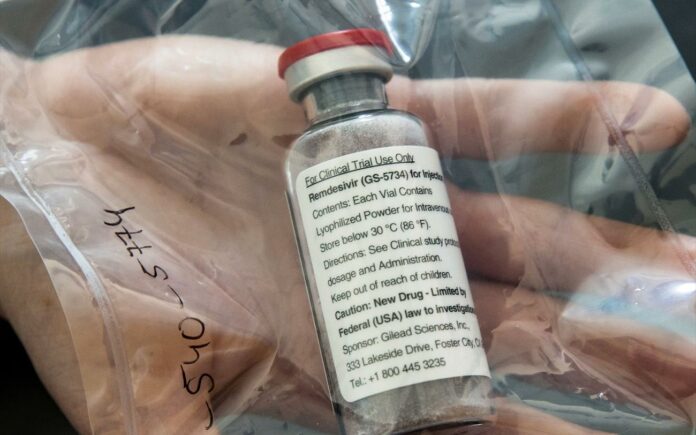
Η ρεμντεσιβίρη (remdesivir), ένα ερευνητικό φάρμακο, το οποίο δεν έχει λάβει ακόμη έγκριση από καμία κανονιστική αρχή στον κόσμο και για καμία ένδειξη, δείχνει να έχει σύμφωνα με τους επιστήμονες αποτελεσματικότητα έναντι του κορωνοϊού.
Σύμφωνα με το γενικό διευθυντή της Gilead Sciences Ελλάδος – Κύπρου, Σάββα Χαραλαμπίδη η έρευνα της Gilead για τη συγκεκριμένη δραστική ουσία είχε ξεκινήσει πριν από μια δεκαετία. Μέσα από πολλές δοκιμές, αποτυχίες και επαναλήψεις, παρατήρησαν τελικά ότι η δραστική ουσία remdesivir μπορεί να έχει θεραπευτική δυναμική έναντι της COVID-19. Γι αυτό και ανέλαβαν ως εταιρεία άμεσα πρωτοβουλίες για να επιταχύνουν την ανάπτυξη φαρμάκου.
Προσδιόρισαν την αποτελεσματικότητα και την ασφάλεια του remdesivir ως μιας δυνητικής θεραπείας και ξεκίνησαν κλινικές μελέτες Φάσης 3 σε χώρες με σημαντική επιδημιολογική επιβάρυνση. Επιπροσθέτως, η εταιρεία υποστηρίζει όλες τις κλινικές μελέτες επιστημονικών φορέων (μεταξύ άλλων NIAID – στην οποία συμμετέχει και η Ελλάδα – WHO, INSERM, κ.ά.) ανά τον κόσμο, παρέχοντας δωρεάν το ερευνητικό φάρμακο.
Ενώ, επενδύει στην αύξηση της δυνατότητας παραγωγής, ακόμη και πριν βεβαιωθούν ότι το remdesivir θα είναι αποτελεσματικό. Ήδη από τον Ιανουάριο έχουν αυξήσει κατά 30 φορές τη δυνατότητα παραγωγής του remdesivir, χωρίς να θέσουν σε κίνδυνο επάρκειας καμία άλλη από τις θεραπείες που παρέχουν. Επίσης μείωσαν τον χρόνο της εξαιρετικά πολυσύνθετης και χρονοβόρου διαδικασίας παραγωγής του από 12 σε 6 μήνες. Επιπλέον, δημιουργούν μια κοινοπραξία φαρμακευτικών και χημικών εταιρειών, προκειμένου να επιταχύνουν περαιτέρω την παραγωγή.
Στόχος της εταιρεία, είναι να έχουν έτοιμες προς διάθεση θεραπείες για 1 εκατομμύριο ασθενείς μέχρι το τέλος του 2020.
Η Gilead όπως λέει, δεσμεύεται ότι θα διασφαλίσει την υπεύθυνη πρόσβαση στο remdesivir ακόμα και μετά από μια δυνητική έγκριση. Εκτός από τις κλινικές μελέτες, στις οποίες έχουν διαθέσει δωρεάν φάρμακο, το remdesivir έχει ήδη χορηγηθεί δωρεάν για τη θεραπεία περισσότερων από 1.700 ασθενών, στο πλαίσιο προγράμματος εξατομικευμένων αιτημάτων παρηγορητικής φροντίδας, ενώ, ήδη ξεκίνησαν σε πολλές χώρες, μεταξύ των οποίων και στην Ελλάδα, δωρεάν πρόγραμμα διευρυμένης πρόσβασης, προκειμένου να επιταχύνουν την πρόσβαση στο φάρμακο για τους ασθενείς που δυνητικά μπορούν να ωφεληθούν από τη θεραπεία.
Το remdesivir ανάμεσα στις 5 επικρατέστερες θεραπείες στον ΕΜΑ έναντι του COVID-19
Το remdesivir είναι μεταξύ των επικρατέστερων θεραπειών για το COVID-19 που υποβάλλονται σε κλινικές δοκιμές για την αξιολόγηση της ασφάλειας και της αποτελεσματικότητάς τους έναντι της νόσου. Τα άλλα 4 είναι:
- lopinavir / ritonavir (που είναι επί του παρόντος εγκεκριμένο ως φάρμακο κατά του HIV),
- χλωροκίνη και υδροξυχλωροκίνη (που επί του παρόντος έχουν εγκριθεί σε εθνικό επίπεδο ως θεραπείες κατά της ελονοσίας και ορισμένων αυτοάνοσων ασθενειών όπως η ρευματοειδής αρθρίτιδα),
- συστηματικές ιντερφερόνες και ειδικότερα ιντερφερόνη βήτα (που είναι επί του παρόντος εγκεκριμένη για τη θεραπεία ασθενειών όπως η σκλήρυνση κατά πλάκας),
- μονοκλωνικά αντισώματα με δραστικότητα έναντι συστατικών του ανοσοποιητικού συστήματος
Όπως αναφέρει ο Ευρωπαϊκός Οργανισμός Φαρμάκων(EMA) είναι απαραίτητο να γίνουν μεγάλες σε πληθυσμό κλινικές μελέτες, καθώς είναι απαραίτητες για τη δημιουργία των ισχυρών δεδομένων που είναι αναγκαία για την καθιέρωση αποδεικτικών στοιχείων για τα φάρμακα που λειτουργούν και, συνεπώς, για την παροχή κατάλληλων συμβουλών στους επαγγελματίες του τομέα της υγείας και των ασθενών και για τη λήψη ρυθμιστικών αποφάσεων, όπως γνωστοποιείται από την Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση του ΕΜΑ (CHMP).
Γενικά, τα χρονοδιαγράμματα για την ανάπτυξη φαρμακευτικών προϊόντων είναι δύσκολο να προβλεφθούν, όπως λέει καθώς, με βάσει τις διαθέσιμες πληροφορίες και την προηγούμενη εμπειρία με τα χρονικά πλαίσια ανάπτυξης των εμβολίων μπορεί να χρειαστεί τουλάχιστον ένας χρόνος πριν το εμβόλιο κατά του COVID-19 είναι έτοιμο για έγκριση και διαθέσιμο σε επαρκείς ποσότητες ώστε να καταστεί δυνατή η ευρεία χρήση. Ενώ, η επαρκής παροχή δόσεων για την κάλυψη των αναγκών όλων των χωρών της ΕΕ πρέπει να προβλεφθεί προληπτικά.
Ειδικές συστάσεις τους ΕΜΑ για την παρηγορητική χρήση του remdesivir
Επιπροσθέτως, η Επιτροπή Φαρμάκων Ανθρώπινης Χρήσης (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων εξέδωσε ειδικές συστάσεις για το ερευνητικό αντιιικό φάρμακο remdesivir σχετικά με τον τρόπο, με τον οποίο θα πρέπει να χρησιμοποιηθεί για τη θεραπεία της νόσου του κοροναϊού (COVID-19) σε προγράμματα παρηγορητικής χρήσης (compassionate use programmes) στην Ευρωπαϊκή Ένωση.
Να θυμίσουμε ότι το remdesivir το οποίο χορηγείται ενδοφλέβια με έγχυση (στάγδην) είναι ένας «αναστολέας της ιογενούς πολυμεράσης RNA» (ένα φάρμακο που παρεμβαίνει στην παραγωγή του ιικού γενετικού υλικού, εμποδίζοντας τον πολλαπλασιασμό του ιού). Έχει δείξει ευρεία δραστηριότητα in vitro έναντι διαφορετικών ιών RNA, συμπεριλαμβανομένου του SARS-CoV-2 που αναπτύχθηκε αρχικά για τη θεραπεία της νόσου του ιού Ebola.
Τα προγράμματα παρηγορητικής χρήσης, τα οποία εφαρμόζονται ξεχωριστά στα κράτη μέλη της ΕΕ, έχουν ως στόχο να δώσουν στους ασθενείς που υποφέρουν με ασθένειες που είναι απειλητικές για τη ζωή ή που είναι μακράς διαρκείας ή που δύναται να προκαλέσουν σοβαρές αναπηρίες και που δεν υπάρχουν έχουν άλλες διαθέσιμες θεραπευτικές επιλογές, πρόσβαση σε φάρμακα που βρίσκονται ακόμη υπό ανάπτυξη και που δεν έχουν λάβει άδεια κυκλοφορίας. Στην περίπτωση αυτή, η Εσθονία, η Ελλάδα, οι Κάτω Χώρες και η Ρουμανία ζήτησαν τη γνώμη της CHMP σχετικά με τις προϋποθέσεις για έγκαιρη πρόσβαση στο remdesivir μέσω παρηγορητικής χρήσης σε ασθενείς με COVID 19. Σε σοβαρές περιπτώσεις, ο COVID-19 μπορεί να προκαλέσει πνευμονία, οξύ αναπνευστικό σύνδρομο, ανεπάρκεια οργάνων και το θάνατο.
Όπως ανέφερε ο επικεφαλής της CHMP, δρ Harald Enzmann οι κλινικές δοκιμές αποτελούν σταθερή αξία για τη συλλογή ισχυρών δεδομένων σχετικά με την ασφάλεια και την αποτελεσματικότητα των δοκιμαζόμενων φαρμάκων. Ωστόσο η CHMP αναγνωρίζει την ανάγκη για μια εναρμονισμένη προσέγγιση αναφορικά με την παρηγορητική χρήση εντός της ΕΕ ώστε να επιτραπεί η πρόσβαση στο remdesivir σε ασθενείς που δεν είναι επιλέξιμοι για να συμπεριληφθούν σε κλινικές δοκιμές.
Η CHMP ενθαρρύνει την εταιρεία να διαθέσει το remdesivir με δίκαιο και διαφανή τρόπο σε εκείνα τα κράτη μέλη που επιθυμούν να συμμετάσχουν σε διεθνείς κλινικές δοκιμές ή να θεραπεύσουν ασθενείς με προγράμματα παρηγορητικής χρήσης.
Το remdesivir έχει αποδειχθεί ότι είναι δραστικό έναντι των SARS-CoV-2 και άλλων τύπων κοροναϊών (δηλ. SARS-CoV και MERS-CoV) σε εργαστηριακές μελέτες. Ωστόσο, υπάρχουν μόνο περιορισμένα δεδομένα σχετικά με τη χρήση του remdesivir σε ασθενείς με COVID 19.
Ο στόχος των συστάσεων της CHMP για το remdesivir είναι να εξασφαλίσει μια κοινή προσέγγιση όσον αφορά στα κριτήρια και στις προϋποθέσεις για τη χρήσης του, πριν από την έγκριση των προγραμμάτων παρηγορητικής χρήσης από τα κράτη μέλη. Οι συστάσεις αφορούν στα κράτη μέλη της ΕΕ που εξετάζουν το ενδεχόμενο δημιουργίας ενός τέτοιου προγράμματος και η εφαρμογή τους δεν είναι υποχρεωτική. Εκτός από την περιγραφή των ασθενών που μπορούν να ωφεληθούν από το φάρμακο, οι συστάσεις εξηγούν πώς να χρησιμοποιηθεί το remdesivir και δίνουν προκαταρκτικές πληροφορίες σχετικά με την ασφάλειά του.